以前、エリンガム図の見方に関して解説した記事をあげたところ、多くの方が参考にしてくださいました。
今回は補足説明ということで、エリンガム図内の直線の切片と傾きがそれぞれ何を示しているかを解説します。
そもそもエリンガム図とは何ぞやという方は、まずこちらの記事を参考にしてください。
また、参考記事を用意しています!
・エリンガム図での平衡酸素分圧の読み方をわかりやすく解説します
・エリンガム図に関する問題を解いてみる【例題:技術士第一次試験(金属部門)】
それでは解説を始めます!
反応ギブズエネルギーΔGの計算方法
エリンガム図(Ellingham diagram)とは、物質の酸化のされやすさを視覚的にわかりやすく表現した図です。
横軸に温度、縦軸に各物質の酸化反応の標準反応ギブズエネルギー変化(ΔG)を示しています。
そもそもΔGの計算式は以下になります。
ΔrG = ΔrH – TΔrS
ここで、
ΔrG : 反応ギブズエネルギー変化 [kJ/mol]
ΔrH : 反応エンタルピー変化 [kJ/mol]
ΔrS:反応エントロピー変化 [kJ/mol]
T : 絶対温度 [K]
を表しています(以下、反応を意味するreactionの頭文字の”r”をつけています)
つまり、ΔrGはTを横軸としたとき、切片ΔrH、傾き-ΔrSの直線を意味しているのです。
切片と傾き
ここで、切片ΔrHは以下で計算できます。
ΔrH =(生成物の生成エンタルピーの合計)ー(反応物の生成エンタルピーの合計)
また、傾き-ΔrSは以下の式で計算できます。
ΔrS=(生成物のエントロピーの合計)ー(反応物の生成エントロピーの合計)
そもそもエントロピーSは”乱雑さ”と表現されます(本当はもっと複雑な概念なのですが、詳細は教科書を参考してください)。
つまり、固体のような規則正しい結晶の状態では、エントロピーは小さく、気体のような分子が飛び回っている状態ではエントロピーが大きくなります。
例えば、
Mn(s) + O2(g) → MnO2(s)
という反応を考えてみます。
この反応では、エントロピーの大きなO2(g)が消失し、エントロピーの比較的小さな固体のMnO2が生成するため、変化量であるΔrSは負の値をとります。
つまり、傾き-ΔrSは正の値となり、右上がりの直線となります。
エリンガム図内の反応はほぼ全て同様な傾向であるため、-ΔrSの大きさはほとんど似た大きさになります。
これはエリンガム図内の直線がほぼ同じ傾きで、右上がりとなっていることからも読み取れます。
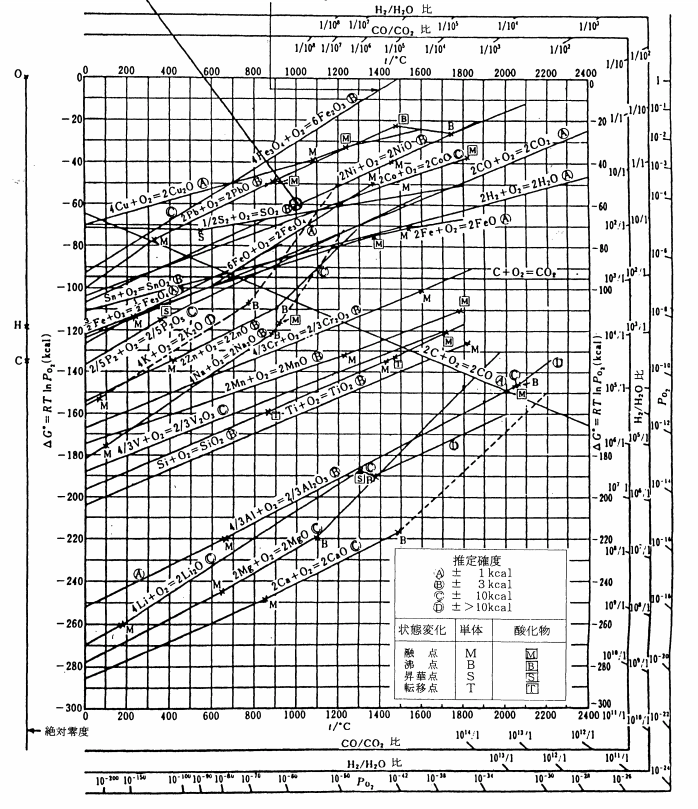
逆に、図中の2C + O2 → 2COという反応は、気体の酸素が1mol消失する一方で、気体のCOが2mol生成する反応であるため、ΔrSは正の値となります。
つまり、傾き-ΔrSは負の値となり、右下がりの直線となります。
同様に図中のC + O2 → CO2という線がほとんど水平になっているのは、反応前後で気体の数が変化しないからです。
また、図中の直線で途中から折れ曲がって、傾きが急になっているものがあるかと思います。
この折れ曲がりについて説明していきます。
次の図は、金属Mnが酸化してMnO2が生じる際のΔrGを表しています(計算は熱力学計算ソフトFactSageで行っています)。
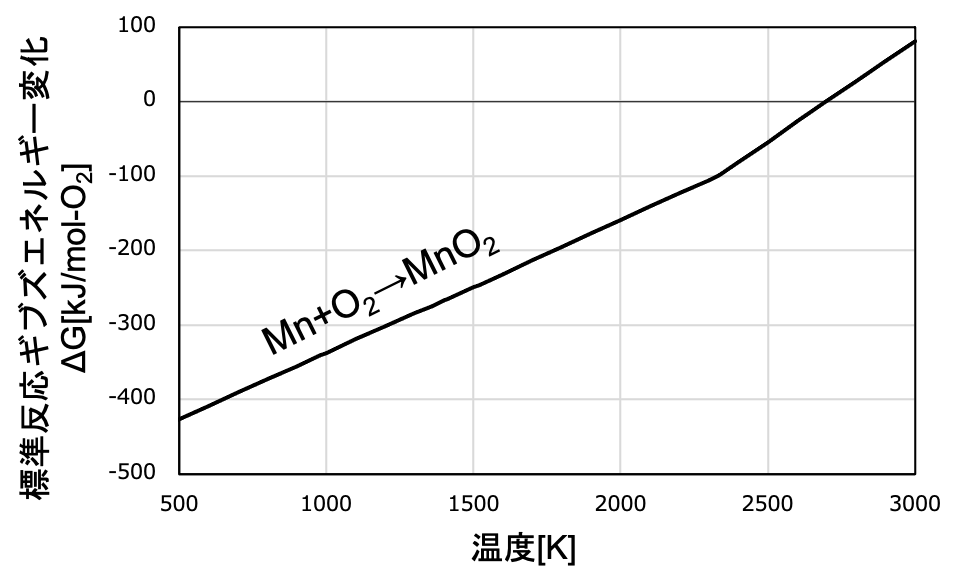
2300K程度で直線が折れ曲がって、傾きが急になっていますね。
この温度はMnの沸点を意味しています。
どういうことかと言いますと、この約2300K以上の温度域では、Mnは気体として存在することとなります。
この時反応式は、Mn(g) + O2(g) → MnO2(s)
エントロピーの大きなO2(g)に加えて、同様にエントロピーが大きいMn(g)が消失し、エントロピーの比較的小さな固体のMnO2が生成するため、ΔrSはさらに大きな負の値をとります。
よって、傾き-ΔrSはより大きな正の値となり、傾きがより急な右上がりの直線となります。
液体のエンタルピーも固体よりは大きいので、Mnの融点でも傾きが急にはなるのですが、液体のエンタルピーは気体ほど大きくはないので、図では読み取れない程度の変化となっています。
まとめ
今回はエリンガム図についての補足説明を行いました。
まとめると、
・エントロピーの大きなO2(g)が消失し、エントロピーの比較的小さな固体が生成するため、ΔrSは負の値をとる(傾き-ΔrSは正となる)
・傾きが急になっている温度は金属の沸点を意味する






