この記事では、私がこれまで紹介したエリンガム図の知識をもとに問題を解いてみます。
例題として技術系の最難関資格である、技術士の第一次試験(金属部門)を紹介いたします。
エリンガム図に関する問題は、金属部門の第一次試験では頻出問題のようで、ほぼ毎年出題されていますね。
今回は令和2年度の過去問を解いていきます!
技術士の第一次試験(金属部門)の問題
技術士の第一次試験の問題と解答は日本技術士会のホームページ(リンク)に掲載されています。
過去問を見てみましたが、エリンガム図に関する問題は大体似たような問題が出ていて、いずれも5つの選択肢の中から最も不適切なものを選べというものです。
それでは令和2年度の問題を見ていきましょう。
令和2年度の問題
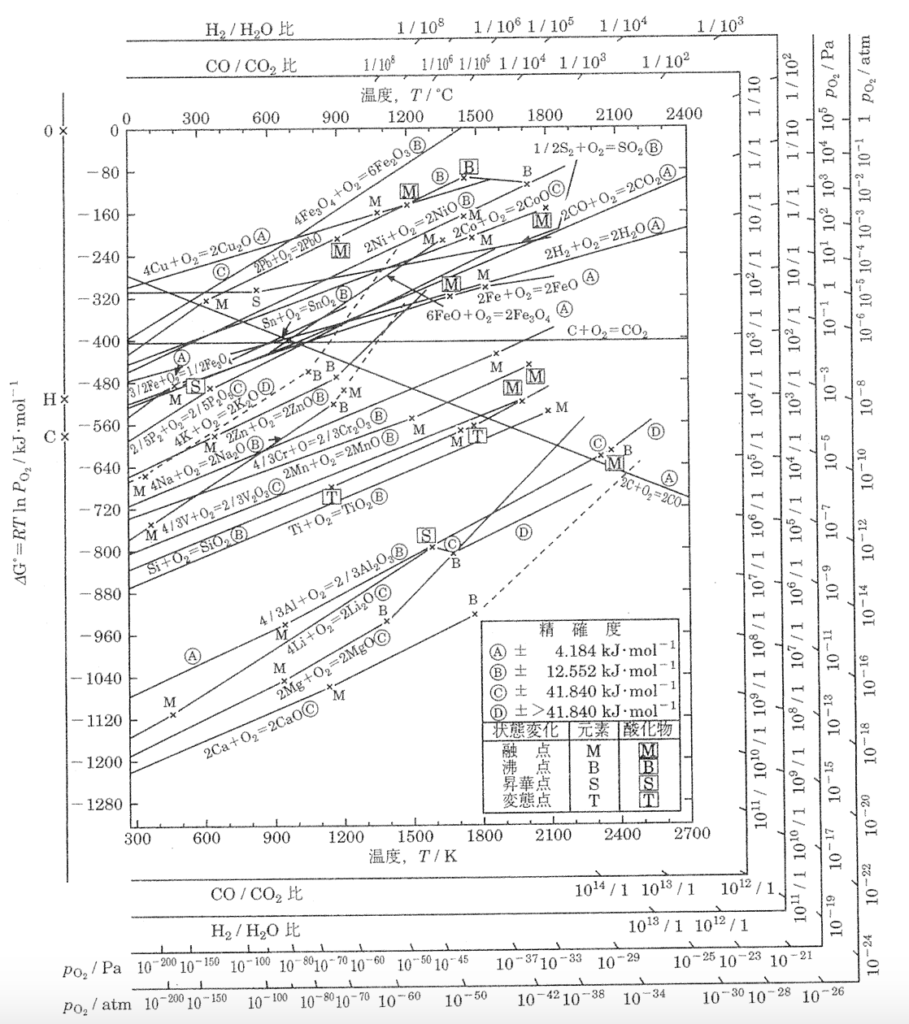
下図は酸素ガス1モル当たりの酸化物の標準生成ギブズエネルギーを温度の関数として表した図(エリンガム図)である。次の①〜⑤の記述のうち、最も不適切なものはどれか。
① それぞれの線(2m/n M + O2 = 2/n MmOn)より上の領域では酸化物が、下の領域では金属が安定である。
② これらの線のほとんどはほぼ同じ傾きを持ち、右上がりになっている。これは、それぞれの酸化反応(2m/n M + O2 = 2/n MmOn)に置いて酸素1モルが消失するため、反応のエントロピー減少量がほぼ同じであることを示している。
③ コバルトの線(2Co + O2 = 2CoO)はリチウムの線(4Li + O2 =2Li2O)より上にあることから、金属コバルトとリチウムの混合スクラップでは、酸化精錬によりリチウムを酸化除去できる。
④ COの生成反応の線(2C + O2 = 2CO)は、その傾きが他の線と大きく異なるが、これはエントロピー変化が負であるためである。
⑤ 左縦軸上のC点、H点は、それぞれ2CO + O2 = 2CO2、2H2 + O2 =2H2Oを表す直線の絶対零度軸における切片である。その値は各反応のエンタルピー変化を表し、それぞれの点を通る直線上では、それぞれCO/CO2比、H2/H2O比の値が一定である。
初見だと結構難しい気がします、、
この問題の正解は、④です(④の記述が不適切です)。
それでは解説していきます!
① それぞれの線(2m/n M + O2 = 2/n MmOn)より上の領域では酸化物が、下の領域では金属が安定である。
→この記述はあっています。こちらの記事で詳細な解説しました。
エリンガム図での平衡酸素分圧の読み方をわかりやすく解説します
(解説)
それぞれの線より上の領域は、酸素分圧が平衡酸素分圧より高い状態を意味しており、酸化物として存在する方が安定となります。
一方で、線の下の領域は酸素分圧が平衡酸素分圧より低い状態を意味しており、この状態に酸化物をさらすと、金属に分解し始めます。
② これらの線のほとんどはほぼ同じ傾きを持ち、右上がりになっている。これは、それぞれの酸化反応(2m/n M + O2 = 2/n MmOn)に置いて酸素1モルが消失するため、反応のエントロピー減少量がほぼ同じであることを示している。
→この記述もあっています。詳細はこちらです。
(解説)
エリンガム図の直線の傾きは、反応のエントロピー変化を意味しています。
気体のエントロピーは固体に比べて非常に大きいので、酸化反応で酸素が消失することでエントロピーは減少します。
固体のエントロピーは物質によって変化しますが、そこまで大差ないため、エントロピー変化(つまり直線の傾き)は酸素の消失による影響が大きく、そのためほとんどの直線が似たような傾きになっています。
③ コバルトの線(2Co + O2 = 2CoO)はリチウムの線(4Li + O2 =2Li2O)より上にあることから、金属コバルトとリチウムの混合スクラップでは、酸化精錬によりリチウムを酸化除去できる。
→この記述も正しいです。
エリンガム図での平衡酸素分圧の読み方をわかりやすく解説します
(解説)
直線が下側にある金属は、上側にある金属よりも比較的低い酸素分圧で酸化物が生成します。
よって金属コバルトとリチウムの混合スクラップを所定の酸素分圧中で酸化精錬すると、リチウムは酸化され酸化リチウムとなりますが、コバルトは金属コバルトのままの状態を保つことができます。
④ COの生成反応の線(2C + O2 = 2CO)は、その傾きが他の線と大きく異なるが、これはエントロピー変化が負であるためである。
→こちらの記述が誤りとなります。
考え方は②と同じです。
直線の傾きは反応のエントロピー変化を意味していますが、COの生成反応では、1モルの酸素が消失して2モルのCOが生成するので、気体は増加します。
つまりエントロピー変化は正となります。
⑤ 左縦軸上のC点、H点は、それぞれ2CO + O2 = 2CO2、2H2 + O2 =2H2Oを表す直線の絶対零度軸における切片である。その値は各反応のエンタルピー変化を表し、それぞれの点を通る直線上では、それぞれCO/CO2比、H2/H2O比の値が一定である。
→この記述は正しいです。
やや説明が難しいのでこちらの記事をご参照ください!
エリンガム図から平衡状態のCO/CO2比とH2/H2O比を求める方法を解説します
まとめ
今回は、エリンガム図の例題として、技術士の第一次試験(金属部門)を紹介しました!
ブログ記事を作成する前からエリンガム図に関しては知っていたつもりだったのですが、調べれば調べるほどうまく作られた図というのを思い知らされます、、
また例題などの解説記事をあげたいと思います!
最後まで読んでいただき、ありがとうございました!





