今回はエリンガム図の見方をわかりやすく解説していきたいと思います。
とはいえ、私は学校の先生でもなければ研究者でもない、ただの技術系のサラリーマンですので、満点の回答をすることはできません笑
ただ、大学での研究や業務で多少はかじったことがあるので、ある程度は理解していると思います。
この記事で、エリンガム図の概念的なことがぼんやり理解できたら、他の図書や文献でもっと詳しく学んでいただければ嬉しいです。
今回、対象としている方は以下の方です!
・取り急ぎ見方を教えてもらいたい人
・なんとなく分かったが理解を確かめたい人
追記 : 補足説明記事を作成しました。こちらも参考にしてください!
・エリンガム図での平衡酸素分圧の読み方をわかりやすく解説します
・エリンガム図から平衡状態のCO/CO2比とH2/H2O比を求める方法を解説します。
・エリンガム図に関する問題を解いてみる【例題:技術士第一次試験(金属部門)】
・標準ギブスエネルギー変化と温度の関係についてグラフ作成方法を解説
エリンガム図とは
エリンガム図(Ellingham diagram)とは、物質の酸化のされやすさを視覚的にわかりやすく表現した図です。
金属精錬などの高温プロセスで使用されることが多いです。この図のことです!
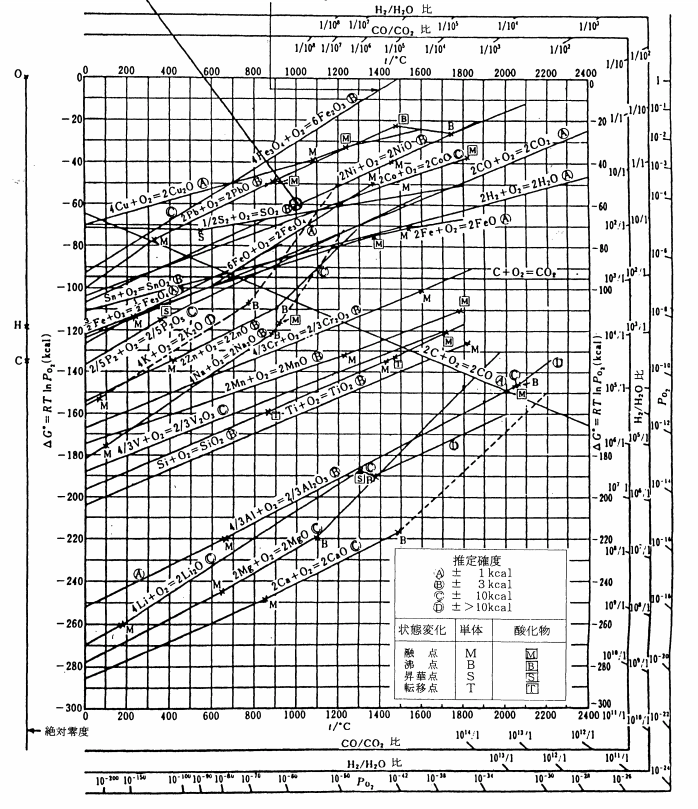
参考:金属の高温酸化(3) -エリンガム図の見方 丸山 俊夫, 材料と環境, 45, 495 (1996)
上の図はたくさん線が書かれていて複雑に見えますので、もっと単純な図を用意しました!
超ざっくりですが、まずはこの程度の理解からで大丈夫だと思います!
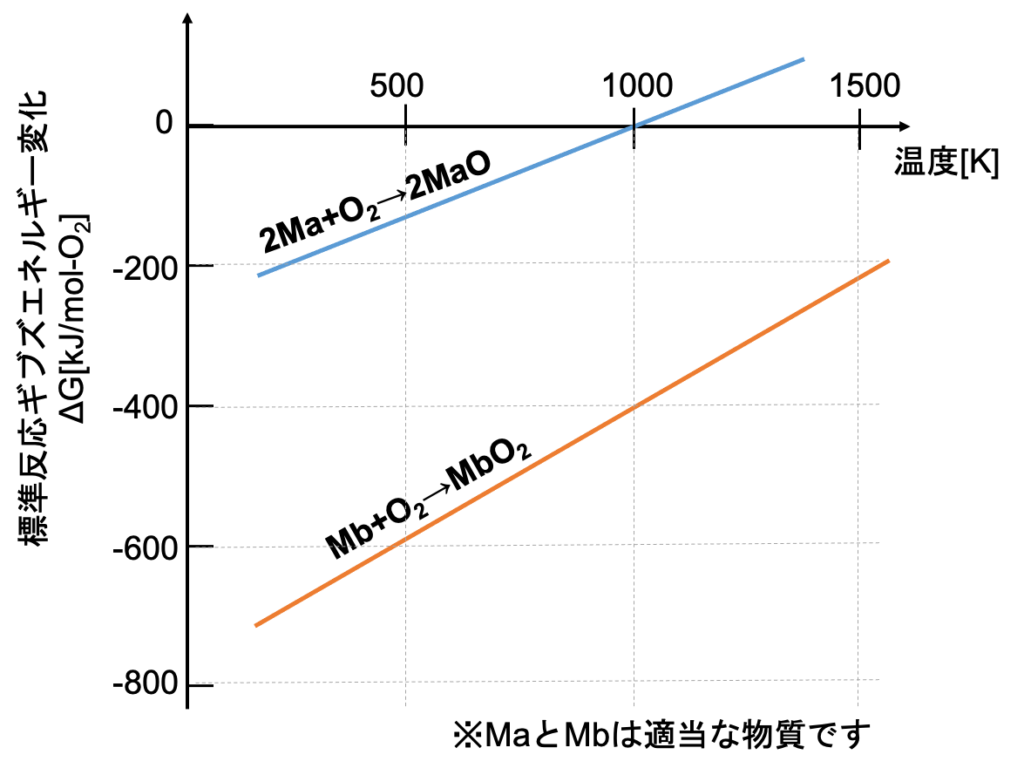
エリンガム図では横軸に温度、縦軸に各物質の酸化反応の標準反応ギブズエネルギー変化(ΔG)を示しています。
地味に大切なことは反応式の酸素の係数を1にしている、つまり単位酸素あたりの反応式で考えていることです(この理由は後述します)。
さすがにΔGの説明はここでは難しいので、教科書を参考していただきたいです!
エリンガム図の便利な使い方
それでは便利な使い方(というより一般的に使われている方法)を説明します。

例えば今から、酸化物MaOと単体Mbの混合物を500Kで酸素がない雰囲気で反応させることを考えます。
この場合、MaOは酸素が奪われMaが生じ、Mbは酸素と反応してMbO2が生成します。
反応式:2MaO + Mb → Ma + MbO2
エリンガム図で位置が下にある元素が、位置が上にある酸化物の酸素を奪うのです。
その逆の反応は熱力学的にあり得ません。
なぜ、そうなるかというと、上図で500Kでのそれぞれの反応は、
①上線 2Ma + O2 → 2MaO ΔG = -150kJ/mol
②下線 Mb + O2 → MbO2 ΔG = -600kJ/mol
となっています。
ここで②下線から①上線を引いてみますと、
Mb − 2Ma → MbO2 − 2MaO ΔG = -450kJ/mol
となり、O2が消去できます(単位酸素あたりの反応式で考える意味はここにあります)。
化学式に「−」は相応しくないので、
Mb + 2MaO → MbO2 + 2Ma ΔG = -450kJ/mol
となります。
ここで大事なのは②下線から①上線を引いた反応のΔG = -450kJ/molと負の値になっており、この反応が自発的に進行するということです。
エリンガム図上で位置が下にあるMbが、位置が上にあるMaOの酸素を奪うということです。
逆に、MaがMbO2の酸素を奪う反応は、ΔG >0となってしまうため、起こり得ません。
もちろん、他の場合でも同様な考え方をすることができます。
例えば、テルミット反応という金属酸化物と金属アルミニウムとの粉末混合物に着火すると、アルミニウムが金属酸化物を還元しながら高温を発生する反応があります。
酸化鉄(Fe2O3)とアルミニウムの反応で考えると、
反応式 Fe2O3 + 2Al → 2Fe + Al2O3
となります。
これはエリンガム図上でAl2O3がFe2O3に比べてかなり下の位置にあるため生じるのです。
逆に金属鉄がAl2O3の酸素を奪う反応というのは熱力学的には起こり得ません。
また、金属どうしの反応に限らず、金属酸化物と炭素との反応、金属酸化物と水素との反応にも利用することができます。
さらに、今回は酸素の奪い合いの反応を考えましたが、硫黄の奪い合いなど他の反応も同様に考えることが可能です。
このように、使い方をマスターすると、データさえあれば他の様々な反応に関しても議論することができるのが便利なところです。
まとめ
今回はエリンガム図に関して、解説しました。
まとめると、
・エリンガム図で位置が下にある元素が、位置が上にある酸化物の酸素を奪う
・金属酸化物と炭素との反応、金属酸化物と水素との反応等にも利用可能
・酸素ではなく、硫黄の奪い合いなどにも応用可能
最後まで見ていただき、ありがとうございました!
追記
補足説明記事を作成しましたので、こちらも参考にしてください!
・エリンガム図での平衡酸素分圧の読み方をわかりやすく解説します
・エリンガム図から平衡状態のCO/CO2比とH2/H2O比を求める方法を解説します。






