今回は絞り膨張(等エンタルピー膨張)によって、蒸気の乾き度がなぜ上がるのかを解説します!
工業的に、絞りによってあえて蒸気の圧力を低下させ、蒸気の乾き度を上昇させることがあります。
このことを蒸気の改質と呼んでいます。
(※炭化水素や石炭から水蒸気を用いて水素を製造する方法とは違います。)
乾き度を英語にすると「quality(質)」なので、そこからきているのだと管理人は勝手に思っています。
それでは解説にうつります。
絞り膨張とは
絞り膨張とは、絞りによって気体の圧力を低下させることにより、気体が膨張する現象のことです。
絞りとは、減圧弁、膨張弁、オリフィス、毛細管(キャピラリーチューブ)のように、流体に故意に圧力損失を発生させ、絞った後の流体の圧力を低くさせる装置です。
より詳細はこちらの記事をご参照ください。
乾き度とは
乾き度とは、蒸気中に含まれている気体の質量割合のことです。
乾き度が高いほど、液体が含まれていないカラカラの蒸気になり、乾き度が低いほど、液体の多いウェットな蒸気になります。
通常、液体の水を加熱すると飽和温度100℃で沸騰し、蒸気が発生し始めます。
その蒸気はしばらくの間、蒸気中に水分を含んだ「湿り蒸気」と呼ばれる状態を保ちます。
そのまま加熱し続けると、やがて水分が完全に蒸発し、蒸気は全てが気相状態の「乾き蒸気(乾き飽和蒸気)」に変化します。
乾き度とは、この「湿り蒸気」の状態の時に、どれくらい蒸気中に気体が含まれているのかを表した指標のことです。
絞り膨張により乾き度が上がる定性的な説明
絞り膨張により圧力が低下すると、蒸気の乾き度は上昇します。
この説明をしていきます。
まず前提として、低圧になればなるほど、沸点は低下します。
例えば、地上で90℃に加熱したお湯を、超断熱してそのまま富士山の頂上に持っていった場合を考えます。
地上は大気圧(101.3kPa)ですが、富士山頂は64kPa程度しかないため、90℃のお湯は山頂では沸騰し、蒸気になります。
これは圧力が下がると、沸点が低下することを示した例です。
また逆の例として、プロパンガスを液化する場合を考えます。
当然プロパンガスはガスなので、通常は気体として存在しますが、室温で0.8MPa程度の圧力をかけると液化します。
これがガスボンベですね。
これは圧力が上がれば、沸点が上昇することを示した例です。
このように、水は圧力が高ければ高いほど沸点が上昇し、圧力が低ければ低いほど沸点が低下します。
ですので、湿り蒸気も圧力を低下させることにより、沸点が低下し、その分蒸発が促進されるというイメージを持つことができると思います。
とは言え、これだとあまりに定性的すぎますので、以下からはP-h線図(モリエ線図もしくはモリエル線図)を使って具体的に解説していきます。
モリエ線図を利用した説明
こちらがモリエ線図です。
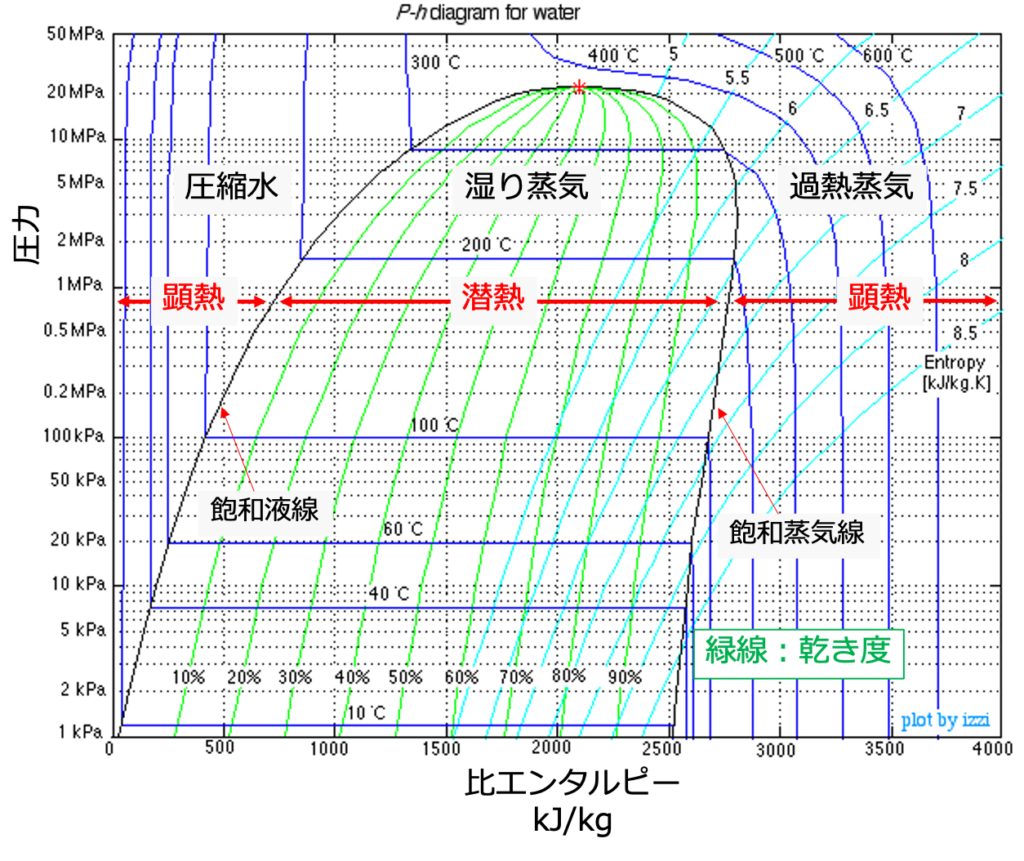
参考:https://www.ohio.edu/mechanical/thermo/property_tables/H2O/
まず、圧力一定の条件で水を加熱していくと、比エンタルピー(保有熱量)が上昇し、状態がグラフの左側から右側へと移動していきます。
圧縮水が加熱されると、飽和液線に到達し、沸騰を開始します。
その後、しばらく湿り蒸気の状態を継続し、加熱とともに乾き度(図中の緑線)が上昇していきます。
飽和蒸気線に到達すると、蒸気は全てが気相の状態となり、乾き飽和蒸気となります。
その後も加熱を継続すると、蒸気は過熱蒸気となります。
ここで、飽和液線に到達するまでの熱量を「顕熱」、飽和液線から飽和蒸気線に到達するまでの熱量を「潜熱」と呼ぶのでした。
さて、続いては、比エンタルピー一定の条件で圧力を下げていくとどうなるのかを説明していきます。

まず、①の状態の湿り蒸気は、圧力2MPa、乾き度は90%の状態です。
絞り膨張による減圧では、エンタルピーは変化しない変化(等エンタルピー変化)となりますので、状態はグラフの上側から下側へと移動していきます。
圧力を0.2MPaまで減圧すると、乾き度は95%程度まで上昇し(状態②)、さらに20kPaまで減圧すると、乾き度100%の乾き飽和蒸気となります(状態③)。
ここからさらに減圧すると、蒸気は過熱蒸気へと変化します。
このように高圧の状態から急減圧することで、一瞬のうちに蒸発して生成した蒸気のことを「フラッシュ蒸気」と呼びます。
絞り膨張による減圧で、乾き度が上昇することをモリエ線図で説明することができました。
モリエ線図では説明できましたが、どういうメカニズムで乾き度が上がるのでしょうか。
それは「等エンタルピー変化(保有している熱量は変化しない)」というのが重要になってきます。
圧力が下がると、沸点は下がりますが、その分保有できる顕熱は減少します。
例えば、加圧して120℃の圧縮水を減圧して100℃で沸騰させた場合、120ー100=20℃分の顕熱は減少することになります。
じゃあ、その顕熱の減少した分はどこに行ったのかというと、潜熱つまり水の蒸発に利用されます。
①圧力を下げる
②圧力を下げた分、沸点も下がる
③沸点が下がった分は、その分だけ保有できる顕熱が少なくなる
④少なくなった顕熱は水の蒸発潜熱に利用される
⑤蒸発した量が増えたので、乾き度は上がる
このような流れによって乾き度が上がります。





